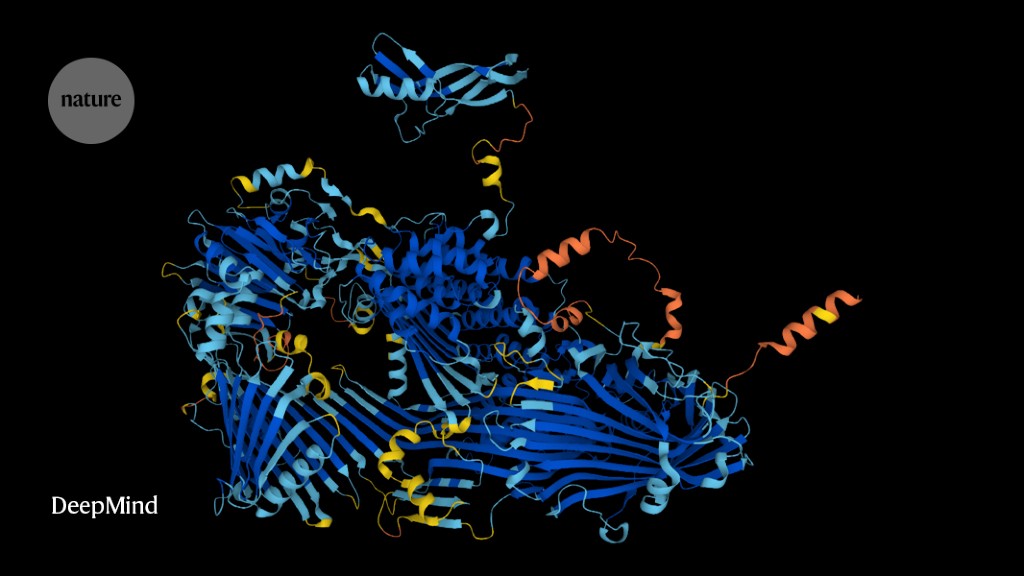
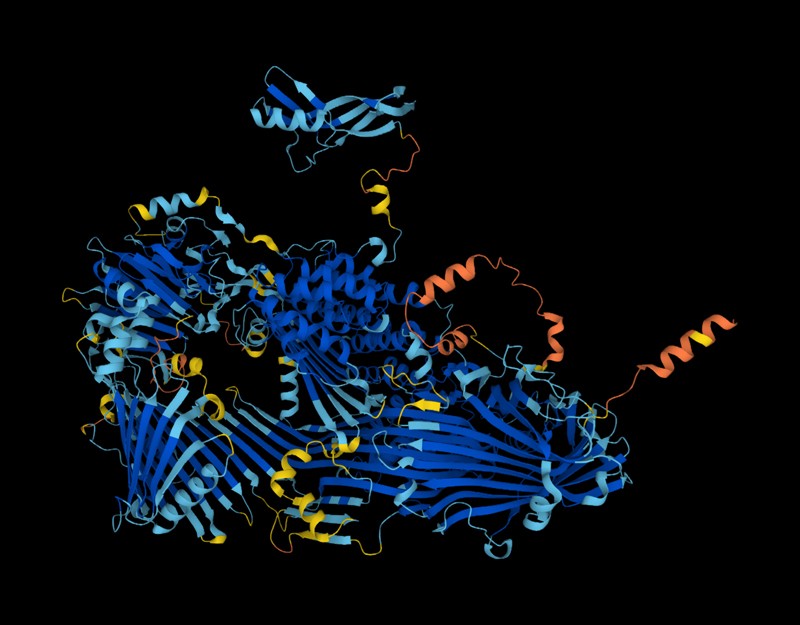
Od dnešného dňa bude určenie 3D tvaru takmer akéhokoľvek proteínu, ktorý veda pozná, také jednoduché, ako jeho zadanie do vyhľadávania Google.
Výskumníci použili AlphaFold – revolučnú sieť umelej inteligencie (AI) na predpovedanie štruktúr takmer 200 miliónov proteínov z 1 milióna druhov, ktoré pokrývajú takmer každý známy proteín na planéte.
Výpis údajov bude voľne dostupný v databáze zriadenej Európskym inštitútom pre bioinformatiku (EMBL-EBI) Európskeho laboratória molekulárnej biológie, londýnskou spoločnosťou Google pre umelú inteligenciu, ktorá vyvinula AlphaFold, a European Molecular Biology Laboratory, medzivládnou organizáciou neďaleko Cambridge, Spojené kráľovstvo. ..
„V podstate si to môžete predstaviť tak, že pokrýva celý proteínový vesmír,“ povedal generálny riaditeľ DeepMind Demis Hassabis na tlačovom brífingu. „Sme na začiatku novej éry digitálnej biológie.“
3D tvar alebo štruktúra proteínu určuje jeho funkciu v bunkách. Väčšina liekov je navrhnutá pomocou štrukturálnych informácií a presné mapy sú často prvým krokom k odhaleniu toho, ako proteín funguje.
DeepMind vyvinula sieť AlphaFold pomocou technológie AI nazývanej hlboké učenie a pred rokom bola spustená databáza AlphaFold s 350 000 predikciami štruktúry, vrátane predpovedí od ľudí, myší a ďalších 19 široko študovaných organizmov. Zahrnutý bol takmer každý vyrobený proteín. Katalóg sa odvtedy rozrástol na takmer 1 milión záznamov.
„Pripravujeme sa na zverejnenie tohto obrovského pokladu,“ hovorí Christine Orengo, výpočtová biologička z University College London, ktorá použila databázu AlphaFold na identifikáciu nových rodín proteínov. „Všetky údaje pre nás Je úžasné predpovedať.“
vysoko kvalitné konštrukcie
Vydanie AlphaFold minulý rok spôsobilo rozruch v komunite vied o živote, ktorá sa snažila tento nástroj využiť. Sieť robí vysoko presné predpovede 3D tvaru alebo štruktúry proteínov. Poskytuje tiež informácie o presnosti svojich predpovedí, takže výskumníci vedia, čomu majú dôverovať. Vedci tradične používajú časovo náročné a drahé experimentálne metódy, ako je röntgenová kryštalografia a kryoelektrónová mikroskopia, na rozlíšenie proteínových štruktúr.
Podľa EMBL-EBI sa asi 35 % z viac ako 214 miliónov predpovedí považuje za vysoko presné, čo znamená, že sú len také dobré ako experimentálne určené štruktúry. Zvyšných 45 % bolo považovaných za dostatočne sebavedomých, aby sa mohli spoľahnúť na viaceré aplikácie.
Viacnásobné alfafoldové štruktúry sú dostatočné na nahradenie experimentálnych štruktúr pre niektoré aplikácie. V iných prípadoch výskumníci používajú alfafoldové predpovede na overenie a pochopenie experimentálnych údajov. Zlé predpovede sú často jasné a niektoré z nich sú spôsobené vnútornou poruchou v proteíne, čo znamená, že nemá definovaný tvar, aspoň nie bez prítomnosti iných molekúl.
Dnes zverejnených 200 miliónov predpovedí je založených na sekvenciách v inej databáze s názvom UNIPROT. Je pravdepodobné, že vedci už budú mať predstavu o tvare niektorých z týchto proteínov, pretože sú zahrnuté v databázach experimentálnych štruktúr alebo sú podobné iným proteínom v takýchto úložiskách, povedal Josep Carreras, výpočtový biológ z Leukémie. Výskumný ústav, hovorí Eduard Porta Pardo. (IJC) v Barcelone.
Ale takéto záznamy sú skreslené smerom k ľudským, myšacím a iným cicavčím proteínom, hovorí Porta, takže je pravdepodobné, že skládka AlphaFold pridá dôležité poznatky, pretože priťahuje mnoho rôznorodejších organizmov. „Bude to fantastický zdroj. A pravdepodobne si ho stiahnem hneď, ako vyjde,“ hovorí Porta.
Pretože softvér AlphaFold je k dispozícii už rok, výskumníci už majú schopnosť predpovedať štruktúru akéhokoľvek proteínu, ktorý chcú. Mnohí však tvrdia, že dostupnosť predpovedí v jedinej databáze ušetrí výskumníkom čas, peniaze – a léno. ,Toto je ďalšia prekážka vstupu, ktorú musíte odstrániť,“ hovorí Porta. „Používal som veľa modelov AlphaFold. Sám som AlphaFold nikdy nešoféroval.“
Jan Kosinski, štrukturálny modelár z EMBL Hamburg v Nemecku, ktorý prevádzkuje sieť AlphaFold už minulý rok, sa už nemôže dočkať rozšírenia databázy. Jeho tím strávil 3 týždne predpovedaním proteómu – súboru všetkých proteínov v organizme – patogénu. „Teraz si môžeme stiahnuť všetky modely,“ povedal na brífingu.
sto terabajtov
Mať takmer každý známy proteín v databáze umožní aj nové typy štúdií. Orengov tím použil databázu AlphaFold na identifikáciu nových typov proteínových rodín a teraz to urobí v oveľa väčšom meradle. Jej laboratórium tiež využije rozšírenú databázu na pochopenie vývoja proteínov s užitočnými vlastnosťami, ako je ich schopnosť konzumovať plasty, alebo s obavami, ako sú tie, ktoré môžu zhoršiť rakovinu. Identifikácia vzdialených príbuzných týchto proteínov v databáze môže určiť základ pre ich vlastnosti.
Martin Steiner, výpočtový biológ na Národnej univerzite v Soule, ktorý pomohol vyvinúť cloudovú verziu AlphaFold, je nadšený z rozšírenia databázy. Hovorí však, že výskumníci stále musia sieť prevádzkovať sami. Ľudia čoraz častejšie používajú alfafoldy na určenie toho, ako proteíny interagujú, a takéto predpovede nie sú v databázach. Mikrobiálne proteíny nie sú identifikované ani sekvenovaním genetického materiálu z pôdy, oceánskej vody a iných „metagenomických“ zdrojov.
Niektoré sofistikované aplikácie rozšírenej databázy AlphaFold sa môžu dokonca spoliehať na stiahnutie celých 23 terabajtov obsahu, čo by pre mnohé tímy nebolo možné, hovorí Steiner. Ukladanie v cloude môže byť tiež nákladné. Steiner spoločne vyvinul softvérový nástroj s názvom FoldSeq, ktorý dokáže rýchlo nájsť štruktúrne podobné proteíny a ktorý by mal byť schopný výrazne dešifrovať údaje AlphaFold.
Aj po zahrnutí každého známeho proteínu bude potrebné aktualizovať databázu AlphaFold, keď sa objavia nové organizmy. Predpovede AlphaFold sa môžu tiež zlepšiť, keď budú k dispozícii nové štrukturálne informácie. Hassabis hovorí, že DeepMind sa zaviazal dlhodobo podporovať databázu a že môže každý rok vidieť aktualizácie.
Dúfa, že dostupnosť databázy AlphaFold bude mať trvalý vplyv na biologické vedy. „Bude si to vyžadovať obrovskú zmenu myslenia.“

Web nerd. Extreme organizer. Writer. Whole foods evangelist. Certified introvert.